МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ Руководящие указания по приготовлению и производству культуральных сред Часть 1 Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории ISO 11133-1:2000
ПредисловиеЦели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения» Сведения о стандарте 1 ПОДГОТОВЛЕН Государственным учреждением «Научно-исследовательский институт эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Российской академии медицинских наук на основе русской версии стандарта, указанного в пункте 4 2 ВНЕСЕН Техническим комитетом по стандартизации ТК 335 «Методы испытаний агропромышленной продукции на безопасность» 3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 18 декабря 2008 г. № 478-ст 4 Настоящий стандарт идентичен международному стандарту ИСО 11133-1:2000 «Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории» (ISO 11133-1:2000 «Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 1: General guidelines on quality assurance for the preparation of culture media in the laboratory») 5 ВВЕДЕН ВПЕРВЫЕ Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет ВведениеВ микробиологической лаборатории большинство испытаний и процедур зависит от качества культуральных сред, обеспечивающих получение воспроизводимых результатов. Культуральные среды используют во всех традиционных методах выращивания микроорганизмов, а также для множества альтернативных задач. В продаже имеется широкий ассортимент готовых культуральных сред - обезвоженных концентратов. Еще больше составов культуральных сред, предназначенных конкретно для выращивания микроорганизмов, описано в литературе. Кроме того, в лабораториях, занятых микробиологическими исследованиями пищевых продуктов, основными целями является поддержание, оживление, выращивание, обнаружение и/или подсчет самых разнообразных микроорганизмов. Требования к среде являются специфичными как к пробе, так и к искомым микроорганизмам. Поэтому культуральные среды, удовлетворяющие установленным или минимальным критериям эффективности, являются необходимым условием надежных результатов любого микробиологического исследования. Чтобы убедиться в приемлемости каждой партии питательной среды, пригодности среды для решения поставленной задачи и возможности получения на данной среде воспроизводимых непротиворечивых результатов, необходимо выполнить достаточный объем испытаний. Эти три критерия являются важной частью внутреннего контроля качества и при наличии соответствующей документации позволяют осуществлять эффективный контроль культуральных сред, чтобы обеспечивать получение точных и объективных результатов. НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ Руководящие указания по приготовлению и производству культуральных сред Часть 1 Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории Microbiology of food and animal feeding stuffs. Guidelines on preparation and production of culture media. Part 1. General guidelines on quality assurance for the preparation of culture media in the laboratory Дата введения - 2010-01-01 1 Область примененияВ настоящем стандарте предоставлена общая терминология, связанная с обеспечением качества приготовления культуральных сред, и установлены минимальные требования, которые следует использовать для микробиологического анализа продуктов, предназначенных для потребления в пищу и корма для животных. Эти требования применимы к трем категориям культуральных сред, используемых в лабораториях, которые готовят и/или используют культуральные среды для выполнения микробиологических исследований: - коммерческим средам, готовым к использованию; - средам, приготовленным из имеющихся в продаже сухих (обезвоженных) ингредиентов (это или среды, включающие все необходимые для рецептуры ингредиенты, например агаризованная среда для подсчета колоний (plate count agar - РСА) или основные среды, к которым добавляют отдельные ингредиенты, например агаровая среда Байд-Паркера (Baid-Parkeragar)); - средам, приготовленным от индивидуальных ингредиентов. 2 Нормативные ссылкиВ настоящем стандарте использованы нормативные ссылки на следующие стандарты: ЕН 1659:1996 Системы для диагностики in vitro. Культуральные среды для микробиологических целей. Термины и определения. ЕН 12322:1999 Средства медицинские для диагностики in vitro. Культуральные среды для микробиологических целей. Критерии эффективности культуральных сред. ИСО 8402:1994 Управление качеством и обеспечение качества. Словарь.1) 1) Стандарт в настоящее время пересматривается и будет объединен с ИСО 9000-1:1994 с целью создания ИСО 9000:2000 «Системы менеджмента качества. Основные положения и словарь». 3 Терминология3.1 Общие положенияВ этом разделе приводятся общие определения, связанные с обеспечением качества, и различные термины, касающиеся питательных сред и выращивания культур. Стандарты, приведенные в скобках, указывают на то, что данный текст идентичен тексту из этих стандартов. 3.2 Термины по обеспечению качества
3.2.4 партия культуральных сред: Полностью прослеживаемая единица среды, относящаяся к определенному количеству концентрата, полуфабриката или конечного продукта, которая изготовлена в соответствии с требованиями производства (контроль в процессе приготовления) и проверена на соответствие установленным требованиям качества, была произведена в течение определенного периода производства и которой присвоен один номер партии. 3.2.5 эффективность культуральных сред: Реакция питательной среды при посеве на нее контрольных организмов при определенных условиях. 3.3 Термины, используемые для характеристики питательных сред
3.3.3.2 плотная культуральная среда и полужидкая культуральная среда: Плотная культуральная среда, содержащая затвердевающие материалы (например, агар-агар, желатин и т.д.,), в различных концентрациях. Примечания 1 Из-за международного использования культуральные среды с затвердителем агар-агаром часто обозначают сокращенно термином «агар» для твердых культуральных сред, например «агар для подсчета колоний на чашках Петри». 2 Твердые культуральные среды, разлитые в чашки Петри, обычно называют «чашка». Твердые культуральные среды, разлитые в пробирки, которые размещают в наклонном положении при затвердевании среды часто называют «косяками» или «скошенным агаром». [ЕН 1659] 3.3.4 Классификация культуральных сред по назначению
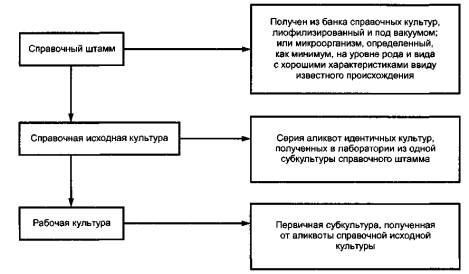
3.4.4 рабочая культура: Первичная субкультура, полученная от контрольного посева контрольной культуры (см. 3.4.3). 4 Методы контроля качества питательных сред4.1 Документация4.1.1 Документация, предоставляемая изготовителем Документация, предоставляемая изготовителем, включает следующее: - наименование среды, отдельных ингредиентов и всех добавок, включая их товарные коды; - код партии; - значение рН среды перед применением; - информацию о хранении и дату истечения срока годности; - оценку эффективности и используемый тест-(микро)организм; - техническую спецификацию; - свидетельство о контроле качества; - данные по опасности/защите (при необходимости). 4.1.2 Контрольная карта лаборатории Контрольная карта лаборатории после получения среды включает следующую информацию: - наименование среды и код партии; - дату получения; - дату истечения срока годности; - состояние и целостность упаковки 4.2 Хранение4.2.1 Общие положения Во всех случаях следуют инструкциям изготовителя, где имеются данные об условиях хранения, сроке истечения и времени использования. 4.2.2 Управление качеством и контроль качества сухих (обезвоженных) сред и добавок Среды поставляют в обезвоженных (сухих) в виде порошка или гранул, в герметично упакованных контейнерах, а добавки различных селективных или диагностических реагентов в лиофилизированной или жидкой формах. Приобретение сред следует планировать таким образом, чтобы обеспечивать регулярный поток (т.е. первым получено - первым использовано). Для поддержания эффективного учета необходимые проверки должны включать в себя: - проверку герметичности; - проверку даты первого вскрытия сред и добавок; - визуальную оценку содержимого открытых контейнеров. После открытия нового контейнера на качество среды может повлиять окружающая среда, в которой хранят открытые контейнеры со средами и добавками. Потеря качества сухих (обезвоженных) сред проявляется в изменении текучести порошка, гомогенности, образовании комков, изменении цвета и т.д. Любую сухую (обезвоженную) среду, которая стала влажной или проявляет очевидные изменения физических свойств, следует исключать из дальнейшей работы. 4.2.3 Коммерческие среды, готовые к использованию В отношении условий хранения, времени использования сред и даты истечения срока годности необходимо соблюдать инструкцию изготовителя. 4.2.4 Среды, приготовленные из имеющихся в продаже доступных сухих (обезвоженных) ингредиентов и основных индивидуальных компонентов Срок годности сред, приготовленных из имеющихся в продаже доступных сухих (обезвоженных) ингредиентов и основных индивидуальных компонентов, различен. Пользователь вправе установить общие сроки хранения приготовленных сред. Специальные международные или национальные стандарты могут предписывать конкретные условия и срок годности. Стерилизованные среды, разлитые в чашки, пробирки или флаконы и реагенты, которые не используются немедленно, должны быть защищены от света и высыхания. Если дата истечения срока годности не была установлена или не указана в международном стандарте, среды, к которым конечные компоненты добавляют непосредственно перед использованием, следует хранить в холодильнике не более 3 мес или при комнатной температуре не более одного месяца в условиях, не допускающих изменения их состава. Однако рекомендуется, чтобы среды, к которым добавляют селективные добавки, использовать в день их приготовления. Плотные среды, содержащие химически активные и/или неустойчивые вещества, следует хранить в таре, в которой осуществляют их плавление. Следует наблюдать за любым изменением цвета, признаками появления пыли, обезвоживания или микробного роста. Партии сред, показывающие такие изменения, не следует использовать. До использования или перед нагреванием рекомендуется доводить среды до температуры окружающей среды. 4.3 Приготовление питательных сред в лаборатории4.3.1 Общие положения Аккуратное приготовление сред - один из фундаментальных принципов в микробиологической экспертизе, и этому необходимо уделять особое внимание. Необходимо следовать хорошей лабораторной практике и инструкциям изготовителя, касающимся работы с сухими (обезвоженными) средами и другими компонентами, входящими в их состав, особенно содержащими опасные материалы, такие как соли желчных кислот или другие селективные компоненты. Когда среды приготовляют из сухих (обезвоженных) коммерческих составов, необходимо точно выполнять инструкции изготовителя. Документ (см. 4.1.1) дополнительно должен содержать информацию о порядке приготовления сред. Для сред, приготовляемых из отдельных компонентов, необходимо строго соблюдать все операции, предусмотренные в инструкции изготовителя. Кроме того, до начала приготовления сред следует проверить полную идентичность (то есть код и номер партии) всех используемых компонентов. 4.3.2 Вода Используемая вода должна быть дистиллированной или равноценной по качеству, то есть освобожденной от веществ, которые могут ингибировать или влиять на рост микроорганизмов при контрольных исследованиях. Если дистиллированную воду приготавливают из хлорированной воды, хлор необходимо нейтрализовать перед дистилляцией. Дистиллированную воду следует хранить в контейнерах, изготовленных преимущественно из инертных материалов (например, нейтральное стекло, полиэтилен и т.д.), которые должны быть свободными от ингибирующих рост микроорганизмов, веществ до их начального использования. Примечание - В некоторых случаях может быть необходимо использовать свежеприготовленную воду, свободную от растворенной в ней двуокиси углерода. Дистиллированная вода хорошего качества должна иметь удельное сопротивление, по меньшей мере, 300000 Ом×см. Предупреждение! Вода, пропущенная через ионообменные устройства (деионизированная), может быть обсеменена высоким количеством микроорганизмов; желательно такую воду не использовать без подтверждения низкого содержания в ней микроорганизмов. За консультацией о выборе лучшего метода минимизации заражения микроорганизмами можно обратиться к изготовителю. Значительно загрязненная микроорганизмами деионизированная вода, которая была стерилизована фильтрованием, может содержать достаточно веществ, подавляющих рост некоторых микроорганизмов. 4.3.3 Взвешивание и перегидратация (растворение) Тщательно взвешивают соответствующее количество сухой (обезвоженной) среды при соблюдении мер предосторожности, чтобы не вдохнуть порошок, особенно для среды, содержащей ядовитые вещества. Для растворения постепенно добавляют требуемое количество воды, избегая образования комков. 4.3.4 Растворение и дисперсия Сухие (обезвоженные) среды нуждаются в быстрой дисперсии путем постоянного перемешивания с нагреванием, если необходимо, для растворения. Средам, содержащим агар, нужно дать несколько минут для впитывания воды с перемешиванием до нагревания. Для сред, приготовляемых из отдельных компонентов, каждый компонент необходимо добавлять отдельно и полностью растворять, прежде чем окончательно довести до конечного объема. 4.3.5 Измерение и получение нужной рН рН измеряют, используя рН-метр, и получают необходимую рН, если среду приготовляют из отдельных компонентов в лаборатории таким образом, чтобы после стерилизации и охлаждения до температуры 25 °С среда имела требуемое значение рН + 0,2 единицы рН, если нет других указаний. Нужное значение рН получают с помощью гидроокиси натрия (NaOH) концентрацией приблизительно 40 г/л (приблизительно 1 мол/л) или соляной кислотой (HCl) приблизительно 36,5 г/л (приблизительно 1 мол/л). Примечание - Имеющиеся в продаже готовые среды могут показывать существенные изменения рН до и после автоклавирования. Однако если используют дистиллированную или деионизированную воду хорошего качества, то получение нужной рН до аквтоклавирования не требуется. 4.3.6 Разливка Среду разливают в соответствующие контейнеры, имеющие объем в 1,2-3 раза, превосходящий объем среды. 4.3.7 Стерилизация 4.3.7.1 Общие положения Стерилизацию культуральных сред и реактивов можно выполнять, используя стерилизацию горячим паром (см. 4.3.7.2) или фильтрацией (см. 4.3.7.3). Определенные среды не нуждаются в стерилизации автоклавированием и их допускается использовать после кипячения. Например, среды для выращивания Enterobacteriaceae, содержащие брилиантовый зеленый, особенно чувствительны к нагреванию и действию и после кипячения должны быть быстро охлаждены и защищены от сильного света. Также некоторые реактивы допускается использовать без стерилизации (см. соответствующий международный стандарт или инструкции изготовителя). 4.3.7.2 Стерилизация горячим паром Стерилизацию горячим паром осуществляют в автоклаве или в специальном аппарате для приготовления культуральных сред. Обычно автоклавирование проводят в течение 15 мин при температуре 121 °С. Для объемов более чем 1000 см3, цикл стерилизации адаптируют соответствующим образом. Во всех случаях следуют в соответствии с инструкциями, данными в стандарте, и инструкциям изготовителей. Работу автоклава контролируют с помощью показаний термопар и индикаторных полосок при типичных условиях, чтобы гарантировать достижение желаемого температурного профиля. Примечание - Может происходить перегревание, когда в автоклаве стерилизуются большие объемы сред (1000 см3). Контроль эффективности стерилизации является существенным в приготовлении культуральных сред. После нагревания следует охлаждать среды способом, предотвращающим выкипание. Это особенно важно для чувствительных сред, например, предназначенных для Enterobacteriaceae, и сред, автоклавируемых в больших объемах. 4.3.7.3 Стерилизация фильтрацией Стерилизация фильтрацией может быть выполнена в вакуумных или герметичных условиях. Используют мембраны и фильтровальные элементы с диаметром пор 0,22 мкм. Они должны быть стерилизованы в автоклаве. При приобретении элементов фильтра и мембран в стерильном состоянии при их использовании следуют инструкциям изготовителя. Стерилизуют различные части аппарата фильтрации в собранном или разобранном состоянии в автоклаве в течение 15 мин при температуре 121 °С. Если необходимо, после автоклавирования сборку в стерильных условиях осуществляют в ламинарном шкафу с очищенным потоком воздуха. Примечание - На некоторых фильтровальных мембранах могут задерживаться белки (такие как антибиотики). Чтобы получать необходимую концентрацию, пользователь должен использовать предварительно увлажненный фильтр. 4.3.7.4 Мониторинг (слежение) После автоклавирования, кипячения или фильтрации во всех средах проверяют значение рН, цвет, стерильность и консистенцию. 4.3.8 Приготовление добавок Коммерческие добавки, содержащие токсические агенты, особенно антибиотики, следует приготовлять с осторожностью, избегая распыления порошка, который может вызывать аллергические или другие реакции у персонала лаборатории. При приготовлении добавок необходимо соблюдать технику безопасности и следовать инструкциям изготовителя. Не допускается использовать добавки с просроченным сроком годности. Например, для рабочих растворов антибиотика срок годности истекает в тот же самый день. При определенных обстоятельствах растворы антибиотика допускается хранить в замороженном состоянии в соответствующих объемах (аликвотах). Не допускается их повторное замораживание после оттаивания. Потенциальная потеря активности вследствие замораживания должна быть обсуждена с изготовителем или определена пользователем. 4.4 Подготовка к использованию4.4.1 Плавление агаровых культуральных сред Плавление культуральной среды осуществляют, поместив ее в кипящую водяную баню или любым другим способом, дающим идентичные результаты (например, в автоклаве с проходящим потоком пара). Среды, которые ранее были автоклавированы, повторно нагревают в течение минимального времени, чтобы сохранять качество среды. Следует избегать перегрева и удалять среду из водяной бани, когда она расплавилась. Охлаждают расплавленную среду до температуры (47 ± 2) °С в водяной бане с контролем температуры в течение времени до ее использования. Время, необходимое для достижения температуры 47 °С, зависит от вида среды, объема и количества флаконов в водяной бане. Расплавленную среду следует использовать, как можно скорее, по возможности, сразу, но не более чем через 4 ч. 4.4.2 Деаэрация культуральных сред Если необходимо, до использования нагревают культуральную среду в кипящей воде или в потоке пара в течение 15 мин, приоткрыв крышку или пробку; после нагревания крышки или пробки плотно закрывают и быстро охлаждают до необходимой температуры. 4.4.3 Введение дополнительных добавок Термолабильные (неустойчивые к нагреванию) добавки следует добавлять в среду после ее охлаждения до (47 ± 2) °С. Стерильная добавка перед добавлением к агаровой среде должна быть доведена до комнатной температуры. Холодные жидкости могут привести к образованию геля из агара или сформировать прозрачные хлопья. Все добавки добавляют в среду осторожно и перемешивают до полного растворения, затем наливают в конечные контейнеры, по возможности, максимально быстро насколько это возможно. 4.4.4 Приготовление и хранение сред в чашках Петри Разливают агаровую среду в чашки Петри, чтобы получить слой толщиной не менее 2 мм (например, для чашек диаметром 90 мм обычно требуется 15 см3 среды). Чтобы дать агаровой среде охладиться и застыть, чашки Петри, закрытые крышками, помещают на прохладную, горизонтальную поверхность. Примечание - В течение инкубации будет происходить потеря влажности агаровой среды. Потеря больше, чем 15 % водного содержимого, может в некоторых случаях неблагоприятно влиять на рост микроорганизмов. Факторы, влияющие на потерю воды, включают в себя состав среды, количество среды в чашках, тип термостата (с вентиляцией или без нее), влажность атмосферы в термостате, расположение и количество чашек в термостате и температуру инкубации. Разлитую и застывшую среду используют немедленно или хранят при условиях, предотвращающих изменение ее состава, то есть в темноте и/или в холодильнике при температуре 4 °С - 12 °С в закрытых контейнерах в течение одной недели или в соответствии с указаниями изготовителя, или указаниями определенного стандарта на конкретный вид исследования. Чашки маркируют, указывая дату приготовления и/или дату истечения срока годности и идентификации. Допускается использовать альтернативные системы кодирования, удовлетворяющие этим требованиям. Срок годности чашек с разлитой агаровой средой можно увеличить, если хранить их в герметично закрытых полиэтиленовых пакетах. Чтобы избежать появления конденсата, чашки необходимо охладить перед помещением в пакеты. Не допускается подсушивание поверхности агаровых чашек перед хранением в охлажденном состоянии. До инокуляции твердой питательной среды на поверхность плотной питательной среды чашки подсушивают, предпочтительно с удаленными крышками и с поверхностью агара, повернутой вниз, в сушильном шкафе при температуре от 25 °С до 50 °С или в ламинарном боксе, пока с поверхности агаровой среды не исчезнут капли влаги. Нельзя пересушивать чашки. Чашки с готовой к использованию агаризованной средой, приобретенной в продаже, должны храниться и использоваться согласно инструкции изготовителя. 4.4.5 Инкубация в термостате Чашки рекомендуется ставить в стопки не более чем по 6 шт. в высоту. Следует оставлять пространство для циркуляции воздушного потока, чтобы среда быстро пришла в равновесие с температурой инкубации в термостате настолько, насколько это возможно. Для жидких сред время для достижения температуры инкубации зависит от ряда факторов, например объема, размещения, типов контейнеров, типов термостата. В случае выращивания в анаэробных условиях может оказаться необходимым сложить чашки в стопки не менее шести чашек в стопке. 4.5 Избавление от средКонтаминированные и неиспользованные культуральные среды следует удалять безопасным способом в соответствии с национальными правилами. 5 Контроль качества конечного продукта5.1 Контроль качества физических характеристикЛабораторное тестирование должно включать в себя, как минимум: - показатель РН, измеренный при температуре 20 °С и 25 °С; - количество заполнения и/или толщину слоя; - цвет; - прозрачность/присутствие оптических артефактов; - стабильность/консистенцию/влажность геля. 5.2 Микробиологический контроль качества5.2.1 Контаминация (заражение) Соответствующее количество от каждой партии должно быть проверено на контаминацию (заражение). 5.2.2 Контрольные микроорганизмы Набор контрольных организмов должен содержать микроорганизмы только со стабильными характеристиками определенного вида, которые дают надежные результаты оптимальной эффективности с определенными, приготовленными в лаборатории культуральными средами. Контрольные организмы должны, прежде всего, включать культуры, которые являются широко доступными в коллекциях эталонных культур и являются хорошо охарактеризованными. Хорошо охарактеризованные микроорганизмы, выделенные в лаборатории, допускается включать в набор контрольных микроорганизмов. Их культуральные характеристики должны быть исследованы и зарегистрированы лабораторией. В контрольном наборе должен находиться штамм с атипичными характеристиками. Предпочтительно использовать штаммы, выделенные из пищевых продуктов, хотя не все коллекции культур предоставляют информацию, касающуюся их происхождения. Контрольные организмы для каждой среды могут включать: - четко положительные штаммы с типичными характеристиками; - слабо растущие положительные штаммы (то есть более чувствительные по происхождению); - биохимически не активные штаммы, например демонстрирующие различные реакции ферментации или флюоресценции; - полностью ингибированные штаммы. Примечание - Международный комитет по микробиологии и гигиене пищевых продуктов (WPCM) описали утвержденный перечень коллекции штаммов для оценки питательных сред [1]. 5.2.3 Готовые к использованию питательные среды и реактивы Изготовители имеющихся в продаже готовых к использованию культуральных сред особенно те, которые одобрены ИСО 9001 [2] или ИСО 9002 [3], имеют программу контроля качества на месте и могут выдавать сертификат качества на культуральные среды, которые они поставляют. При этих условиях пользователь не обязан выполнять обширный объем испытаний приобретенных сред. Необходима только гарантия, что поддерживаются необходимые условия хранения. 5.2.4 Среды, приготовленные из коммерчески доступных сухих (обезвоженных) ингредиентов Качественные тесты на каждую партию приготовленной среды являются минимальными. Для тех сред, которые не содержат никаких индикаторов или селективных веществ, использование одного положительного контрольного штамма в испытании является достаточным. Для тех сред, которые содержат индикаторы или селективные агенты, должны использоваться штаммы, которые выявляют функцию индикатора или селективности. Для сложных сред, то есть питательных сред с использованием добавок, каждую партию необходимо проверить со штаммами, характеристики которых приведены в 5.2.2. В случае готовых к использованию сред, к которым добавляют ингредиенты, приготовленные в лаборатории, используют тот же принцип для проверки. 5.2.5 Среды, приготовленные из основных индивидуальных компонентов Рекомендуется, чтобы в дополнение к качественным тестам, описанным в 5.2.4, выполнялись некоторые количественные исследования при использовании методов типа модифицированной методики Майлса и Мисра (Miles and Misra) [1] или посева на чашки по спирали, чтобы проследить тенденции качества основных материалов, продуктивность питательной среды и последовательность этапов приготовления сред внутри лаборатории. Примечание - В практике пищевые продукты могут содержать микроорганизмы, подвергнутые стрессу. В связи с этим необходимо принимать в расчет способность среды оживления таких находящихся под стрессом микроорганизмов. Информацию по методам консервации и поддержанию культуральных сред и коллекций эталонных штаммов см. в приложении В. Приложение А |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Неверное отклонение |
Возможная причина |
|
Агаризованная среда не способна затвердеть |
Перегревание среды во время приготовления. Низкое значение рН, вызывающее кислотный гидролиз. Использована неправильная навеска используемого агара. Агар неполностью расплавлен. Плохое перемешивание компонентов среды |
|
Неправильное значение рН среды |
Перегревание среды во время приготовления. Плохое качество воды. Загрязнение химическими веществами извне. рН измерен при неправильной температуре. рН измерен на неправильно калиброванном рН-метре. Низкое качество сухой (обезвоженной) среды |
|
Неправильный цвет |
Перегревание среды во время приготовления. Плохое качество воды. Низкое качество сухой (обезвоженной) среды. Неправильное значение рН. Загрязнение среды посторонними ингредиентами |
|
Формирование преципитатов |
Перегревание среды во время приготовления. Плохое качество воды. Низкое качество сухой (обезвоженной) среды. Плохой контроль рН |
|
Ингибирование роста микроорганизмов средой/Низкая продуктивность |
Перегревание среды во время приготовления. Низкое качество сухой (обезвоженной) среды. Плохое качество воды. Неправильное использование прописи среды, т.е. ингредиентов, взвешенных неправильно, и добавок, введенных в неправильной концентрации |
|
Плохая избирательность (селективность) |
Перегревание среды во время приготовления. Низкое качество сухой (обезвоженной) среды. Неправильное использование прописи среды. Добавки внесены неправильно, т.е. среда в чрезмерно высокой или низкой концентрации |
Библиография
[1] Culture media for Food Microbiology. Progress in Industrial Microbiology, vol.34 (1995)/Eds. Corry J.E.L, Curtis, G.D.W. and Baird, R.M. Elsevier, Amsterdam
[2] ИСО 9001:2000 Системы управления качеством. Требования
[3] ИСО 9002:2000 Системы качества. Модель обеспечения качества при производстве, установке и обслуживании
[4] ЕН 1659:1996 Системы для диагностики in vitro. Культуральные среды для микробиологических целей. Термины и определения
[5] ЕН 12322:1999 Средства медицинские для диагностики in vitro. Культуральные среды для микробиологических целей. Критерии эффективности культуральных сред
[6] ИСО 8402:1994 Управление качеством и обеспечение качества. Словарь
Ключевые слова: пищевые продукты, корма, микроорганизмы, культуральные среды, штамм микроорганизмов, жидкие среды, сухие среды, агар, приготовление культуральных сред